pH, Su Değerleri ve İyon Gereksinimleri
pH
pH, suyun asitlik-bazlık durumunu belirten parametredir. Bilindiği üzere saf su tam olarak 7 pH'a sahiptir ki, bu asitlik ve bazlığa eşit mesafede olduğunu yani nötr olduğunu belirtir. 7den küçük olan bütün pH değerleri asidik, 7den büyük olan bütün pH değerleri de bazik olarak adlandırılır. Peki bu sayılar nasıl hesaplanır ve ne anlama gelmektedir?
İlk olarak saf suyun kimyasını, detaylı olarak ele alalım:
Su, H2O moleküllerinden oluşmaktadır. H2O suyun kararlı formudur ve çok çok büyük kısmı, kararlı olan bu halde bulunmaktadır. Bunun yanı sıra, aynı zamanda 2 su molekülü etkileşerek, H3O+ ve OH-iyonlarını da oluşturur. H3O+ asitliğe neden olurken, OH- bazlığı oluşturan iyondur. Saf su içinde 2 iyon bir araya gelip, birer birim H3O+ ve OH- iyonu oluşturacağından, bu iyonların konsantrasyonu eşit ve 10-7 şer molar olarak dengelenmektedir. Ayrıca, konsantrasyon değerleri değişiklik gösterse bile her zaman bu iki iyonun konsantrasyon çarpımı 10-14 değerine eşit olacaktır. (molar terimi, çözelti konsantrasyonunu belirtmek için kullanılır ve Molar=mol/litre formülü ile bulunur).
Peki saf su için 7 sayısı nereden gelmektedir? Asitliği daha kolay ifade etmek için, konsantrasyon değeri, pH olarak yeniden formüle edilmiş, bunu yaparken de -log(H3O+ konsantrasyonu) formülü kullanılmıştır. Saf su için, asitlik konsantrasyonunu formülde yerine koyduğumuzda, pH=-log(H3O+)=-log(10-7)=-(-7log10)=7*1=7 olarak karşımıza çıkmaktadır.
Saf suda herhangi başka bir iyon bulunmadığından ve saf su yalnızca kendi molekülleri ile etkileşimde bulunabileceğinden pH her zaman sabit ve 7 değerindedir. Peki suda başka iyonlar da bulunursa veya iyon eklemesi yapılırsa pH değişir mi? İyon türüne göre farklılık göstermekle beraber, genel olarak pH değişmektedir. Ancak formül aynıdır ve asit konsantrasyonu ne olursa olsun, H3O+ ve OH- iyonlarının konsantrasyon değerlerinin çarpımı 10-14 değerine eşit olacaktır. Bu noktada, pOH terimini de açıklayayım. pOH, pHa benzer şekilde hesaplanmakla birlikte, bazlık değerini simgelemektedir. Nasıl pH hesabında, asitliği oluşturan H3O+ konsantrasyonunu formülde yerine koyduysak, pOH için de OH-iyonu konsantrasyon değerini, -log(OH- konsantrasyonu) formülünde yerine koyacak ve pOH değerini bulacağız. pH ve pOH arasında sabit bir ilişki vardır ve birbirlerine dönüştürmek için; pH=14-pOH veya pOH=14-pH formülleri kullanılır.
Örneklemek gerekirse; saf su için pH=7 ve pOH=14-7=7 dir. Yukarıda belirtildiği gibi, iki iyonun konsantrasyon çarpımları sabit ve p dönüşümü ile toplam 14e eşittir. Benzer şekilde aşağıdaki örneklerde asitlik ve bazlık ilişkilerini görebiliriz:
A: pH=3, pOH=14-3=11 Asidik çözelti
B: pH=2.87, pOH=14-2.87=11.13 Asidik çözelti
C: pH=8.17, pOH=14-8.17=5.83 Bazik çözelti
D: pH=4.5, pOH=14-4.5=9.5 Asidik çözelti
E: pH=7.6, pOH=14-7.6=6.4 Bazik çözelti
..
.
..
..
.
..
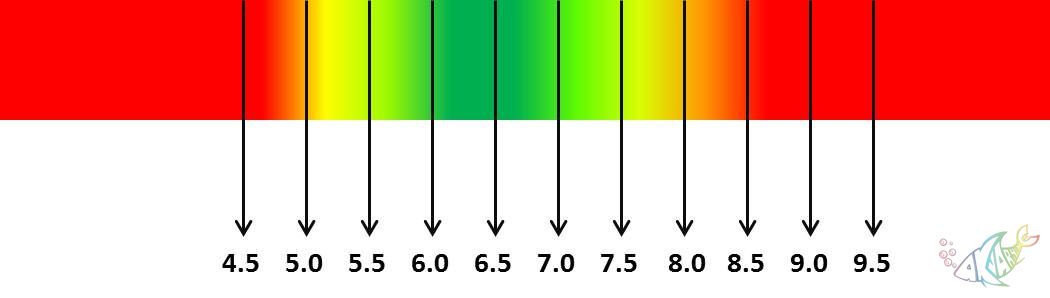
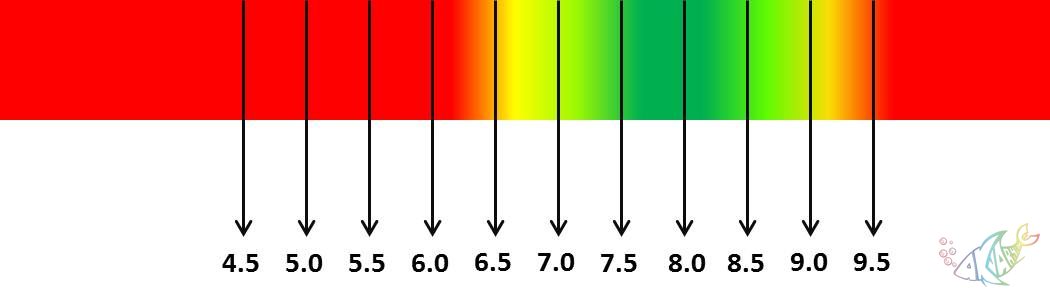
Akvaryum hobisinde çoğunlukla pH terimini kullandığımızdan, bu noktadan itibaren pH üzerinden devam edeceğiz. Terimsel olarak, 7den büyük pH değerleri bazik, 7den küçük pH değerleri asidik çözelti oluşturur demiştik. Peki akvaryumlarda pH sınır değerleri nedir? Akvaryum suyumuz ne kadar asidik veya ne kadar bazik olabilir? Canlıların ve bitkilerin tolerans sınırları nelerdir? Aşağıdaki grafiklerde, tatlı su akvaryumları için optimum pH değerleri belirtilmiştir.
Grafik 1. Bitkili akvaryumlar için uygun pH değerleri grafiği
Grafik 2. Mineralli su (Malawi-Tanganyika) akvaryumları için uygun pH değerleri grafiği
Bitkili akvaryumlar için Grafik 1de gözlenen yeşil pH değerleri en uygun değerlerdir. Kırmızı renk arttıkça risk ve zarar artacaktır. Bitkili akvaryumlardan kasıt, yumuşak su, yani kıyasla asidik ve fazla iyon içermeyen su değerlerinin uygun olduğu akvaryumlardır. Bu gibi akvaryumlarda bitki türleri ile birlikte, amazon balıkları (Discus, tetralar, ramirezi, melek, vs.), canlı doğuranlar, sazansıgiller, kedi balıkları, omurgasızlar (kerevitler, karidesler, yengeçler, salyangozlar, vs.) ve daha pek çok tür canlı beslenebilir. Bu gibi canlılar, doğal habitatlarında nehir kaynaklı sular içinde yaşadıklarından, yüksek iyonlu ve/veya bazik sulara uyumlu değillerdir. Aynı şekilde Malawi ve Tanganiya çikletleri de habitatları gereği yüksek pH ve sertlikte sulardan hoşlanırlar. Peki neden? Bu noktada, doğal habitatlarda neden su değerlerinde farklılıklar olduğunu ele alalım.
Su ve iyon ilişkisini ele alırken, ilk olarak çok duyular genel sertlik (general hardness (GH)), karbonat sertliği (carbonate hardness (KH)), toplam çözünmüş katılar (total dissolved solids (TDS)), milyondaki parça (parts per million (ppm)) sert su, yumuşak su, ters ozmos (reverse osmosis (RO)) gibi terimleri açıklayalım. Açıklamalar sonrasında detaylı olarak ilişkilendirme yapacağız.
Genel Sertlik (GH)
Genel sertlik, GH kısaltması ile ifade edilen ve su içinde çözünmüş bütün iyonları hesaba dahil eden terimdir. Su içindeki tortu ve iyonlar toplamı bu terim ile ifade edilir. Genel sertlik, yağmur suyunun toprak ile etkileşimi sonucu içerisinde iyonlar çözmesi ile veya tortuların su içinde askıda kalmasıyla oluşur. Bunun yanında göl suları, çoğunlukla yeraltı sularından beslendiğinden, yeraltında tuzları bakımından zengindir. Çünkü kaynak suları yüzeye hareket sırasında güzergahı üzerinde bulunan tuzları çözer ve birikintiye taşır. Deniz suyu için ise durum hepsinin toplamı olarak düşünülebilir. Ayrıca denizlerde buharlaşma oluştuğundan, iyon yoğunluğu da dünyanın oluşumundan bu güne artarak doygun hale erişmiştir. Denize erişen her türlü yüzey ve yeraltı suyu bir takım iyonları denize taşır. Denizden de buharlaşma eseri sürekli saf su çıkışı olur. Buharlaşan saf su yoğunlaşıp dünya yüzeyine erişip, iyon toplayarak tekrar denize karışır. Tüm bu döngü eseri yeryüzünde veya yeraltında bulunan mineraller denizlere taşınır. Bu sebeptendir ki, deniz suyu sertliği 6600ppm civarındadır. Nehir suyu genel sertliği değişmekle birlikte 0-375ppm iken, göl suları yeraltı kaynaklarından beslendiği için 0-1000ppm arası değerlere sahiptir. Nehir ve göl sularının GH değerlerinin geniş aralık bulundurması coğrafi etkilerden kaynaklanmaktadır. Yaşlı bir nehir deltası mineralleri milyonlarca yıl süpürür ve denize taşırsa, çözebileceği az miktarda alüvyon kalacağından düşük GH değerine sahip olabilecekken, kıyasla genç bir delta zengin alüvyon içeriğinden dolayı yüksek GH değerine sahip olabilir. Genel sertliği azaltmak için suyu havalandırmak (şebeke sularına eklenen klorun gaz haline dönüşüp uçurulması için), su arıtıcıları kullanmak (genellikle tortu ve renk verici organik maddeleri süzer) veya ozmos filtreler kullanmak (aşağıda detaylı olarak açıklayacağız) yararlı olur. İhtiyaca göre başka metodlar geliştirilebilir veya uygun metod seçilebilir.
Karbonat Sertliği (KH)
Karbonat sertliği ise KH kısaltması ile ifade edilen ve su içinde yalnızca çözünmüş karbonat ve bikarbonat iyonlarını hesaba dahil eden terimdir. Çok yoğun su döngüsüne maruz kalan habitatlarda karbonat sertliği düşük olacaktır. Buna karşılık birikintilerde KH değerleri yüksek olacaktır. Sebep açıktır; yüksek su döngüsü bulunan deltalarda iyonlar bir şekilde taşınır. Bunu yıkamak olarak düşünebilir. Sınırlı miktarda mineral içeren deltalarda, yüksek debili nehir akıntıları mineralleri yıkayarak denize ulaştıracaktır. Ancak göllerden yalnızca buharlaşma ile su hareketi oluşacağından, iyon miktarları yeraltı su kaynakları dolayısıyla bellir bir noktaya kadar artış gösterecek ve sabitlenecektir. Bu yüzden göl suları sodalı, yani karbonatlı olarak bilinir. Canlılar da habitatları icabı karbonata mukavemet gösterebilir. Amazon nehrinde su çok az iyon içerdiğinden, amazon canlıları düşük KH tercih edeceklerdir. Benzer şekilde kristal karideslerin doğal habitatları, asyanın yüksek yağmur alan nehirleri olduğundan ve bu sular mineral içermeyecek kadar yumuşak olduğundan bu canlılar karbonata tahammül edemezler. Karbonat sertliğini azaltmak için ozmos filtre en uygun metottur. Suyu kaynatarak karbonatı karbondioksite çevirerek de KH azaltılabilir ancak bu teknik, akvaryum kullanımında çok verimli olmayacaktır. Çünkü suyu kaynatmak muazzam enerjiler gerektirecek ve bu durum çok masraflı olacaktır.
Toplam Çözünmüş Katılar (TDS)
Genel sertlikle aynı olmakla birlikte ifade ediliş şekli farklılık gösterir. Suda çözünen tüm iyon ve katıları kapsar.
Milyondaki Parça (ppm)
İngilizcesi parts per million olan ve bir milyon çözücü içinde kaç parça çözünenin olduğunu ifade eden terimdir. Hem GH hem de KH değerlerini ifade etmek için kullanılabilir. 1ppm, 1mg/l olarak ifade edilir. Örneklemek gerekirse, TDS değeri 200ppm olan bir akvaryum suyunda litre başı 200 miligram çözünmüş iyon/tortu bulunmaktadır. Litre olarak ele alırsak, 100 litre ise akvaryum, toplamda 200mg*100litre=20 gram su haricinde çözünmüş iyon/katı bulunur. Aynı şekilde ozmos filtre örneği verelim. Diyelim ki ozmos filtrenizden 6ppm su çıkışı alıyorsunuz. Bu litre başı 6 miligram iyon bulunduğunu işaret eder. 100 litre için de 6mg*100litre=600 miligram bulunur. Tekrar belirtelim, ppm litre başı değerdir. Eğer akvaryumunuzda 200ppm değerini okuyorsanız, bu 200mg/litre değeridir.
| GH | KH | TDS |
GH | 1 | - | 17.85ppm |
KH | - | 1 | 17.85ppm |
TDS | 0.056 | 0.056 | 1 |
Tablo 1. TDS, GH ve KH arasındaki ilişki tablosu
Sert Su
İçinde çok yüksek miktarda iyon, tortu vs içeren sudur (≥375ppm). Göl suları sert su olarak ifade edilebilir. 375ppm altı, akvaryumlar için kabul edilebilir derecede yumuşak olarak kabul edilebilirken, 375ppm üzeri sert olarak kabul edilmektedir.
Yumuşak Su
İçinde düşük miktarda iyon, tortu vs içeren sudur (≤375ppm).
Derece | Ppm cinsinden değer | GH değeri |
Yumuşak | 0-100ppm | 0-5.6 |
Orta Sert | 100-375ppm | 5.6-21 |
Sert | 375-800ppm | 21-45 |
Çok Sert | 800+ ppm | 45+ |
Tablo 2. Akvaryum canlıları için su sertliği değerleri tablosu
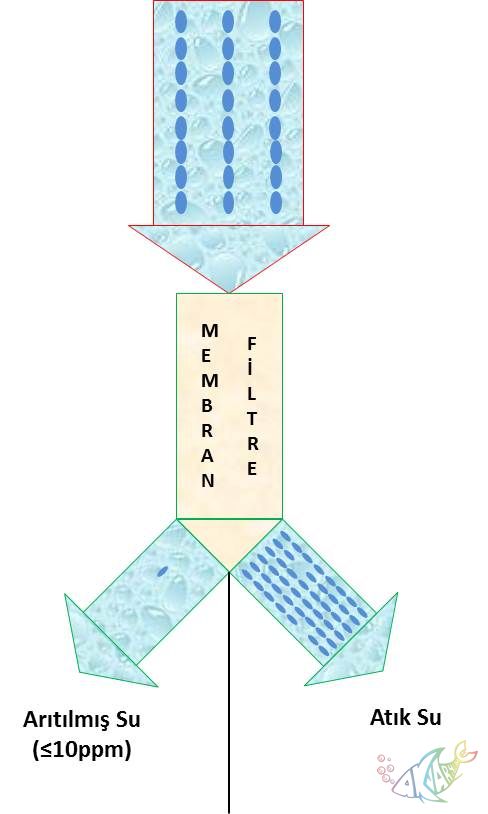
Ters Ozmos (RO)
Ozmos, yüksek iyon konsantrasyonlu bir ortamın, çevresindeki düşük iyon konsantrasyonu bulunan bir ortamdan su alarak şişmesidir kısaca. Ters ozmos için ise bu durum tam terstir. Bir membran filtre kullanılarak su iki parçaya ayırılır ve belli miktarda iyon içeren su iki parçaya ayırılır. Bu parçaların biri saf suya yakın derecede az iyon içerirken (maksimum 10ppm), diğer parça ilk değerin iki katı civarında iyon içerir.
Grafik 3. Ozmos filtrenin basitleştirilmiş çalışma prensibi
Su Değerlerinde Değişiklikler Yapmak
pHı Artırmak veya Azaltmak
pHı Artırmak
Akvaryum suyumuzun pH değerini artırmak istiyorsak yani suyumuzu daha bazik hale getirmek istiyorsak yapacağımız şey suya baz çözeltisi eklemek olacaktır. Bunu yaparken elimizde kesinlikle pH değişimlerini takip edebileceğimiz bir pH metre olmalı. pH kağıtları da yararlı olabilir ancak hassasiyet bakımından düşük olduklarından pH metre kadar iyi sonuç vermeyeceklerdir. Sonuç olarak bir şekilde pH değişimlerini takip etmek durumundayız. Bu noktada 2 farklı durum için pH artırmayı ele alacağız.
1.Bitkili akvaryum/Asidik su canlıları akvaryumunda pH beklediğimizden çok düşük ise:
Aşırı miktarda karbondioksit eklenmesi veya suya salınım yapan bir malzeme dolayısıyla akvaryum suyumuzun pH değeri aşırı düşebilir. Bu durumda pH metre ile takip ederek suya damla damla baz çözeltisi eklemeliyiz. Eklemeleri yavaş ve aralıklı yapmak pH metrenin değişimleri takip etmesine yardımcı olacaktır. Peki baz çözeltisini nereden bulacağız veya hazırlayacağız? Bunun için sodyum hidroksit (NaOH) veya ihtiyaca göre potasyum hidroksit (KOH) uygun olacaktır. Eğer imkanımız var ise ve akvaryumumuz bitkili ise potasyum hidroksit, potasyum sağlaması açısından daha uygundur. Fakat sonuçta pH ayarlayacak kadar düşük miktarda ekleme yapacağımızdan ve bulunabilirliği daha kolay olduğundan sodyum hidroksit de işimize yarayacaktır. Her iki tür içinde yapacaklarımız aynı olacağından sodyum hidroksit üzerinden yazıya devam edeceğim. Marketlerde satılan lavabo açıcılar (Mr. Muscle, Bim lavabo aç, vs.) katı sodyum hidroksitten oluşmaktadır. Açık havada ve deriyle temas ettirmeden, soğuk suyla dolu 500ml bir pet şişeye yarım paket kadar lavabo aç eklenerek stok çözelti hazırlanır. Bu çözelti aşındırıcıdır ve 5-10 günden uzun süre saklanmamalıdır. Kesinlikle göz ve deri ile temasından sakınılmalıdır. Temas halinde ise, sirekeli su ile temas eden bölge yıkanmalıdır (göz hariç. Gözle temas halinde acilen hastaneye başvurunuz). Hazırlanan stok çözelti, bir damlalık kullanılarak yavaş yavaş ve pH metre ile takip edilerek akvaryuma eklenir. Her 10 damlada bir 20-30 saniye ara verip pHın dengelenmesi beklenmelidir. Arzu edilen pH değerine ulaştığınızda, izleyen birkaç gün pHı takip ediniz. Bir kez dengelendiğinde, yoğun su değişimleri yapmadıkça veya suya salınım yapan bir etken olmadıkça pH sabit kalacaktır. İlk bakışta korkutucu bir süreç olarak gözükse de, özenli ve dikkatli bir şekilde gerçekleştirildiğinde zararsız olarak pH ayarlanabilmektedir.
1.Malawi-Tanganyika Çikletleri için şebeke suyu pHını yukarı çekmek:
İlk maddede açıklanan prosedür bu durum için de aynen geçerlidir. İlkinden farklı olarak, bu madde için karbonat kullanarak da pH ayarlaması yapılabilir. Yumuşak su canlılarının bulunduğu akvaryumlarda karbonat kullanımı sorunlar çıkarabildiği için karbonat kullanımını tavsiye edilmemektedir. Ancak çiklet akvaryumlarında karbonat kullanımı sorun çıkarmayacaktır. Kullanıma gelirsek, suya yavaş yavaş ve pH metre ile takip ederek karbonat eklenir. Eklenecek karbonat, litre başı 70-80 miligrama kadar kabul edilebilecektir. Eğer hala arzu edilen değerler gözlenemediyse, NaOH çözeltisiyle ph yükseltmeye devam edilebilir. Çiklet akvaryumlarında karbonat kullanılmasının bir diğer yararı ise, tampon kapasitesi oluşturularak pH değerinin değişiklik göstermesinin engellenebilmesidir. Tampon kapasitesi oluşturabilen iyonlar karbonat, sülfat, fosfat gibi iyon kökleridir. Bu gibi iyonlar, suda yeni oluşan/oluşabilecek asit ve baz iyonlarıyla etkileşimde bulunarak pH değişikliklerinin önüne geçerler. Saf suya bir damla limon suyu eklendiğinde, pHta 100 birim değişiklik oluştuğunu kabul edersek, yüksek tampon kapasitesine sahip bir suda aynı miktarda limon suyu belki 0.01 birim değişiklik oluşturabilir.
pHı Düşürmek
Akvaryum suyumuzun pH değerini düşürmek istiyorsak, yani suyumuzu daha asidik hale getirmek istiyorsak yapacağımız şey suya asit çözeltisi eklemek olacaktır. Bunu yaparken elimizde kesinlikle pH değişimlerini takip edebileceğimiz bir pH metre olmalı. pH kağıtları da yararlı olabilir ancak hassasiyet bakımından düşük olduklarından pH metre kadar iyi sonuç vermeyeceklerdir. Sonuç olarak bir şekilde pH değişimlerini takip etmek durumundayız.
1. pH beklediğimizden/arzu ettiğimiz değerden çok yüksek ise:
Bu durumda baz kullanarak yapılan düzeltmeyi, asit stok çözeltisi kullanarak yapacağız. Asit stok çözeltisi için sülfürik asit, fosforik asit, asetik asit veya hidroklorik asit kullanılabilir. Peki bu asitleri nereden bulacağız. Sülfürik, fosforik ve hidroklorik asitler konsantre olarak satılmaktadır. Konsantre derken tehlikeli değerlerden bahsediyoruz. Olur da bu konuda bilgi ve tecrübeniz var ise, konsantre asitten 1 molar stok çözelti hazırlayarak kullanabilirsiniz. Ancak tekrar dikkat çekmek isterim ki, piyasada satılan bu asitlerin herhangi bir şekilde vücutla teması, 1. derece yanıklara sebep olacaktır. Bu sebeple bu asitlerin temin edilip kullanılmasını tavsiye etmiyoruz. Ancak bir şekilde düşük konsantrasyonlu çözeltilere erişebiliyorsak pH metre ile takip ederek pH değerini aşağı çekmede kullanabiliriz. Bu asitlere alternatif olarak asetik asit kullanılması çok daha az tehlikelidir. Ayrıca asetik asit yukarıdaki asitlere kıyasla tampon kapasitesi oluşturabildiğinden, kullanımı daha yararlı olacaktır. Asetik asidi basitçe katı limon tuzu kristalleri olarak marketten temin edebiliriz. Bu kristaller 500 ml su içeren bir pet şişe içerisinde bir 10-15 gram koyulacak şekilde çözülür ve stok çözelti hazırlanır. pH metre ile takip ederek, yukarıda pH artırmada açıkladığımız şekilde bu stok çözelti pH düşürmek için kullanılabilir.
GH değerini düşürmek
GH değerini düşürmek için yapılacak olan şeyler ihtiyaca göre, yukarıda açıkladığımız ters ozmos işlemi veya tortu alma işlemidir. Piyasada genel olarak 2 çeşit su arıtıcı bulunmaktadır:
İlki, sudaki tortuyu, bazı organik maddeleri ve bazı iyonları tutabilen artıma sistemleridir. Bu gibi sistemlerde, su ilk olarak çeşitli geçirgenlikte mikron filtre/filtrelerden geçirilip tortudan ayırılır. Mikron filtreler tek kullanımlıktır ve yaklaşık altı aylık periyotlarla değiştirilmeleri gerekir.
Ardından karbon filtreden geçirilen su, suya renk veren ve karbon yüzeye ilgi duyan organik maddelerden arındırılır. Karbon filtre de tek kullanımlıktır ve yüzeyi doldukça (yaklaşık 6 ay) değiştirilmesi gerekir.
Bundan sonra sıra, sudaki kalsiyum ve magnezyum iyonlarını filtreleyen iyon değişim filtresine gelir. Bu filtrede bulunan polimerik malzeme, üzerinde bulunan sodyum iyonları ile kalsiyum ve magnezyum iyonlarını yer değiştirtir. İlk iki aşamada GH bir miktar düşer ancak iyon değişim filtresinde amaç suyu kalsiyum ve magnezyumdan arındırmak olduğundan GH düşmez, aksine artar. Bu artışa sebep bir kalsiyum veya kalsiyuma karşılık iki sodyum çıkışı olmasıdır. İyon değişim filtreleri, belli periyotlarla (6 ay) çok yoğun tuzlu su çözeltilerine yatırılarak yeniden kullanılabilir hale getirilebilir.
İyon değişim filtresinin ardından, eğer sistemde mevcutsa sıra su tatlandırma filtrelerine gelir. Bu üç aşamanın ardından gelen filtreler yine GH artışına sebep olur. Artışın sebebi suyun tadını içilebilir hale getirmek için eklenen bazı organik bitkisel iyon/maddelerdir.
Toplamak gerekirse, bu tür su arıtma sistemleri GH değerini ancak bir miktar düşürebilir. Asıl amaç suyu insan metabolizmasına uygun hale getirmek olduğundan, su temizlenir, saflaştırılmaz.
İkinci metod ise ters ozmos sistemler kullanmaktır. Su arıtıcılarla aynı olarak ters ozmos sistemlerde de ilk iki aşama mikron filtre ve karbon filtredir. Üçüncü aşama ise iyon değişim filtresinden farklı olarak membran filtredir. Yukarıda bulunan açıklamada ve grafik 3te belirtildiği gibi membran filtre sudaki tüm iyon ve tortuyu, ters ozmos işlemi ile atık olarak ayırırken temiz su çıkışından saf suya yakın su verir. Ters ozmos sistemlerde mikron ve karbon filtre kullanılmasının amacı membran filtrenin ömrünü uzatmaktır. Tek başına kullanıldığında çok hızlı şekilde tıkanacağından, membran filtreden önce mikron ve karbon filtre kullanılır. Membran filtreler tek kullanımlıktır ve 2 yıla kadar işlevini yerine getirebilmektedir. GH değerini düşürmek için asıl etkili yöntem, açıklamalardan da anlaşılabileceği üzere ters ozmos sistemlerdir. Ancak burada dikkat edilmesi gereken husus, ters ozmos sistemlerde bu üç filtrenin kullanılması gerektiğidir. Çünkü membran filtre çıkışına bağlanan filtreler suya iyon/madde vermeyi amaçladığından GH değerini artırıcı etki oluşturacaklardır ve akvaryum kullanımında gereksizlerdir. Ayrıca membran sonrası filtrelerin kullanımı gereksiz yere ek maliyetler oluşturacaktır.
KH değerini düşürmek
GHa benzer şekilde KH değerini düşürmek için de yukarıdaki metodlar kullanılabilir. Aynı şekilde ters ozmos KH düşürmede etkilidir. Suyu kaynatarak, karbonat iyonlarını karbondioksit gazına dönüştürerek de KH düşürülebilir ancak bu yöntem çok çok pahalı olacaktır.
KH değerini artırmak
KH değerini artırmak için basitçe suya karbonat eklenmelidir. Arzuya göre bir TDS metre kullanarak istenen miktarda karbonat eklenebilir ve KH artırılabilir.
Suya Karbondioksit gazı (CO2) eklemek
Bitkili akvaryumlarda, karbondioksit fotosentez için gerekli bir bileşendir ve bitkilere karbondioksit sağlanmalıdır. Ancak CO2 kullanımı bir zorunluluk değildir ve dikkatli olunmalıdır. Tankta az miktarda bitki ve kıyasla fazla miktarda canlı var ise CO2 kullanımına ihtiyaç olmayabilir. Böyle bir durumda suya CO2 eklenmesi pHı aniden çok düşük değerlere çekebilmekte, bu durumda bitkilerin yanmasına neden olabilmektedir. Ayrıca doğada, bitkilerin bulunduğu habitatlar akvaryumda sağlanan miktarda CO2içermez. Normalden bir miktar fazla CO2 eklenmesi fotosentezi, dolayısıyla gelişim hızlandırır ancak ekleme yüksek miktarlarda yapılmamalıdır. Karbondioksit kaynağı olarak pet şişede mayalı sistemler, piknik tüpü veya yangın tüpünde mayalı sistemler olduğu gibi karbondioksit tüpleri de kullanılmaktadır. Aşağıdaki linkte, piknik tüpü ile DIY piknik tüplü mayalı sistem yapım aşamaları mevcut.
Bitkili akvaryumlarda iyon gereksinimleri
Tatlı su bitkileri sağlıklı gelişim gösterebilmek için potasyum, fosfat, nitrat ve çeşitli eser elementlere ihtiyaç duyarlar. Doğada bu ihtiyaçlarını, nehirlerin alüvyonları çözerek taşıması ile karşılayabilen bitkiler, akvaryumlarda kısıtlı miktarda iyona erişebilirler. Ayrıca her türün iyon gereksinimi ve iyon emilim hızı farklılık göstereceğinden, suda bazı iyonlar, bitki türleriyle ilişkili olarak daha hızlı tükenir. İyon eksikliği dolayısıyla bitkilerde çeşitli form ve renk bozuklukları meydana gelebileceği gibi yapraklarda delikler ve gelişimin durması da gözlenebilir. Bu duruma çözüm olarak suya iyon takviyesi yapılabilir. Ancak bunu yaparken kullanılan iyonların içerik ve miktarları iyi tahlil edilmelidir.
Bahçe bitkilerinden hatırlanacağı gibi, çok yüksek miktarda veya dengesiz besin eklemek, bitkilere faydadan çok zarar verecektir. Bu durum akvaryum bitkilerinde daha hassastır. Akvaryum bitkilerinin gelişimleri, 500ppm üzeri sertlikte sularda durmakta, daha sert sularda çürümeler başlamaktadır. Ayrıca pH 5.0 ve altında aynı şekilde bitkilerin hayatta kalması mümkün olmamaktadır. Tüm bu sorunlara ek olarak, akvaryum bitkilerinde, dengesiz besin takviyesi neticesinde yosun oluşumları gözlenmektedir. Sakal yosunundan yeşil alge kadar pek çok yosun türü, suda hazır halde bulunan eser element ve aminoasitler yardımıyla hızlı gelişim gösterir. Yosun türleri primitif canlılar olduklarından, suda serbest halde bulunan vitamin ve aminoasitleri bitkilerden çok daha hızlı kullanarak, bitkilerden daha hızlı gelişim gösterirler. Bu durum, bitkiler için sağlanan yararlı iyonların yosunlar tarafından tüketilmesine, dolayısıyla bitkilerin de besinsiz kalarak gelişimlerini durdurmalarına neden olur. Bu sebeple aminoasit ve vitamin içeren bitki besinleri, akvaryum bitkilerinde yosun gelişimini tetikleyici etki gösterirler ve bitkiler için sağlanan iyonların yosunlar tarafından tüketilmesine yol açarlar. Bu tür besinlerin kullanımından kaçınılmalıdır.
Bitkili akvaryum suyunda gereksiz, zararlı ve zararsız iyonlar
Şebeke suyunda bulunan pek çok iyon bitkili akvaryum kullanımı için gereksizken, bazı çeşitler de zararlıdır.
Örneğin şebeke suyu dezenfeksiyon amaçlı olarak yüksek miktarda klor iyonu içerir. Klorun akvaryum canlıları için yararlı bir etkisi bulunmamakla birlikte fazlası zararlıdır. Gereken doz halihazırda yemlerden veya suda arta kalan klordan sağlanacağı için klorun arıtılması yararlıdır. Hobiciler klordan kurtulabilmek için, genelde suyu havalandırma yoluna başvururlar. Dinlendirilen (açık havada bekletilen) veya havalandırılan suda, iki klor iyonu bir araya gelerek klor gazını oluşturur. Oluşan klor gazı, suda çözünürlüğü çok düşük olduğundan uçar ve su klordan arındırılır. Ancak bu tepkime belirli bir seviyeye kadar gerçekleşeceğinden suda yine belli bir miktar klor kalır. Klordan kurtulmanın en etkili yolu ters ozmos yöntemidir.
Sodyum şebeke suyunda fazlaca bulunan ancak bitkiler veya canlılar üzerinde zararlı etkisi bulunmayan bir iyondur. Arıtılmasının yarar sağlayabileceği gibi arıtılmadan kullanılmasının doğrudan bir zararı olmayacaktır.
Sülfat iyonu pek çok pozitif yüklü iyonun anyonu olarak suda bulunur ancak canlılar veya bitkiler üzerinde zararlı etkisi yoktur.
Bakır iyonu bitkiler için gerekli iyonlardan birisidir. Ancak bitkiler bu iyona yüksek konsantrasyonlarda ihtiyaç duymadıklarından, yemler vs vasıtasıyla sağlanması yeterlidir. Bakır gereğinden fazla miktarda kullanıldığında zararlı etki ortaya çıkarmaktadır. Oksidasyon değerindeki farklılıklar neticesinde, bitkilerde ve özellikle omurgasız canlılarda inhibite etki gösterebilmektedir.
Amonyak canlı dışkılarının ilk ürünü olarak ortaya çıkabilen ve canlılar üzerinde zararlı etki gösteren bir iyondur. Filtrasyon kabiliyeti yüksek akvaryumlarda çok hızlı olarak oksitlenerek nitrit ve nitrata dönüştürüleceğinden zararlı etkisi düşürülmüş olur. Canlı yükü yüksek ve filtrasyonu zayıf akvaryumlarda bitkiler üzerinde doğrudan ve çok zararlı etki gösterir.
Üre akvaryumda olmaması gereken bir azotlu atık bileşiğidir. İşlenip zararsız formlara dönüştürülmesi zahmetli olan bu bileşiğin akvaryuma eklenmesi bitkilere doğrudan zarar verir. Azot kaynağı olarak üre içeren bitki besinleri kesinlikle akvaryuma eklenmemelidir. Zirai azot ve nitrat gübrelerinde üre bulunduğu için akvaryumlarda kullanılmasından sakınılmalıdır.
Hidrojen Peroksit kimi hobiciler tarafından yosun kurutucu olarak akvaryumda kullanılmaktadır. Ancak bu bileşik bir radikalik başlatıcıdır ve akvaryumdaki canlılar için zararlıdır. Etkileşimde bulunduğu tüm hücreleri öldürür. Yosunların kurutulmasında kullanılmasının nedeni, yosunların, bitkilere kıyasla daha basit yapıda olmalarıdır. Yosunlar etkileşim sonrası hayatta kalabilecek güçte olmadıklarından kururlar ancak bitkilerin yalnızca bazı hücreleri ölür. Kalan hücreler yeniden gelişim gösterdiğinden hayatta kalır. Ancak balıklara veya omurgasızlara temas durumunda en iyi ihtimalle canlı üzerinde yaralar oluşturacaktır. Kullanımı tavsiye edilmemektedir.
Elimden geldiğince su değerlerini ifade eden kavramları açıklamaya çalıştım. Eksik kalan noktalar üzerinde, bu başlık altında tecrübeli hobiciler ile bilgi paylaşımı yapmaya devam ederiz umarım. Saygılar, sevgiler
Beğenenler: [T]147478,AkvaryumElazığ[/T][T]100597,twinsoul[/T][T]169284,cafermutlu[/T][T]98555,asimsek73[/T][T]63393,Biologist[/T][T]109954,ArdaEla[/T][T]121139,braweheart[/T][T]102462,ibrahimuysal[/T][T]128959,m_esin[/T][T]168154,xanadu[/T][T]110242,SGY[/T]
Üye imzalarını sadece giriş yapan üyelerimiz görebilir
Üye imzalarını sadece giriş yapan üyelerimiz görebilir
Üye imzalarını sadece giriş yapan üyelerimiz görebilir
Harun bey,
bildiğim kadarıyla Gh, sudaki kalsiyum ve mağnezyum iyon miktarları hakkında bilgi veriyor.
Yani kural olarak suya 1kg sodyum katsanız
tuzluluğunuz ve iletkenliğiniz artar ancak gh ınız değişmez.
Her iyonun canlılar üzerindeki etkileri
aynı olmadığından ölçüm basitliği vesair sebepler de birleşince ve sudaki ca,
mg miktarını anlamak önemli ölçüde su hakkında fikir verdiğinden ve bunlar
sabunun köpürmesini engellediğinden vesair olsa gerek adına genel sertlik
denmiş ama, bütün iyonlar bu genel sertlik kavramı içerisinde yer
almıyor.
Genel sertliğin yumaşaklık ve sertliğini
gösteren ölçümleme miktarlarınız da bizim akvaryumlarımız için bildiğimiz
değerlerden farklı gözüküyor. 0-4 dgh yani 4*17,85=70 ppm sulara yumuşak su
deniyor, sonra sırasıyla gidiyor, gh rakamını 4 dediğinizde bunun alman mı
fransız sertliği mi olduğunu vurgulamak gerekiyor. 1 alman sertliği 17,85 ppm caco3 yapıyor. Hem ppm değerleriniz hem de sertlik tanımları genel kabul görmüş değerlerle
uyuşmuyor gibi gözüküyor.
Diğer taraftan sertliğin cao olarakmı caco3 olarak mı ifade edildiğine dikkat etmek gerekiyor yani ppm de neyin ppm i. 70ppm coco3 şeklinde ifade edilirse bu 4 alman sertliği yani 4dgh ediyor. Bir de hesaplayanlar dikkat etsinler bu caco3 biçiminden bir ifade olup sadec ca iyonunu hesaplayabilmek için co3 kısmının çıkarılması gerekir. Mağnezyumun getireceği sertlikte ise eşdeğeri bir hesaplama yapılıyor, şu kadar mgco3 şu kadar caco3 e tekabul eder cinsinden bir hesaplama yapılıyor ve mg sertliği de caco3 biçiminde ifade ediliyor.
1 Alman sertliği: 1000 mL suda 10 mg CaO, 1 Fransız sertliği: 1000 mL suda 10 mg CaCO3
1 İngiliz sertliği: 700 mL suda 10 mg CaCO3, 1 USA sertliği: 1000 mL suda 1 mg CaCO3
Suyun sertliği | Alman | Fransız | İngiliz |
Çok yumuşak | 0 - 4 | 0 - 7.2 | 0 - 5 |
Yumuşak | 5 - 8 | 7.3 14.2 | 6 - 10 |
Orta sert | 9 - 12 | 14.3 21.5 | 11 - 15 |
Oldukça sert | 13 - 18 | 21.6 32.5 | 16 22.5 |
Sert | 19 - 30 | 32.6 54.0 | 22.5 37.5 |
Çok sert | > 30 | > 54 | > 37.5 |
1 USA sertliği = Fransız sertliği x 10 | |||
Yine bildiğim kadarıyla suyu
kaynattığımızda co3, co2 ye dönüşmüyor, su ısındığında suda çözünmüş bulunan co2 sudan iyice uçuyor,
bu hem ph artırıcı bir unsur olduğundan ve yüksek ph da hco3 ler co3 e doğru
kaydığından ve ısının da etkisi ile kalsiyum iyonları ile karbonat iyonları birleşerek caco3 (kalsit)
olarak çökeliyor, yani suyu kaynattığınızda kh ı oluşturan co3 ve hco3
iyonları, çökeldiğinden su kh bakımından yumuşuyor, yoksa co3 ler co2 ye
dönüştüğünden değil. Tabii aynı zamanda kalsiyum iyonları da çökeldiğinden gh
bakımından da su yumuşuyor. (magnezyum için de aynı şey geçerli tabi, buna
geçici setlikde denebiliyor, sülfat köklü olanlar kalıcı sertlik oluşturuyor
çünkü kaynatmakla çökmediğinden)
Diğer taraftan Co3 ü veya hco3 iyonlarını
co2 ye döndürerek kh ı düşüren şey ise asittir. Mesela hco3- + hcl à
h2o + co2 + cl- gibi.
Bir de güçlü asit ve bazların tamponlama
kabiliyeti olmadığından bunlarla ph düşürmek veya yükseltmeye kalkışmak
bildiğim kadarıyla doğru değildir ve riskli uygulamalardır.
Ph yükseltmek için en bilinen ve uygun
yöntem nahco3 olup hem ph ı aşırı yükseltmez hem de tamponlama özelliği
göstererek ph ı 8,4 civarlarında tutmaya çalışır.
Ph düşürmek için ise, en uygun yöntem kh
düşürmektir, bunu asitle yaparsanız yani aside kh ı yedirirseniz asidin kökü
suda kalır, yukarıdaki örnekte klorür iyonlarının kaldığı gibi.
Bu açıdan uygun ph ve kh ı yakalamanın
(tabi bir akvarist için) tek yolu kh dan geçer, yüksek ph istiyorsanız yüksek
kh ınızın olması gerekir, düşük ph istiyorsanız düşük kh ınızın olması gerekir.
Yemlerin çürümesi, nitrifikasyon vesair süreçler hep asitleyici süreçler
olduğundan zaten çeşitli organik düşük ph tamponları zaten akvaryumlarda
kendiliğinden oluşur.
Bu asitler de kh ı aynı zamanda ph ı
zamanla aşağı çeker, bütün yemlenen akvaryumlarda ph zaten aşağı düşme
eğilimlidir.
Ne kadar az balık ne kadar az yem
kullanılır ise ve kh da yüksek ise stabil yüksek ph oluşur, tersi durumlarda da
tersi oluşur.
Kısacası akvaryum suyu devamlı işleyen ve
değişim halinde olan bir su olup, tamponsuz asit ve baz kullanılarak ph ı
bunlarla aşağı yukarı hareket ettirebiliriz yaklaşımı, bildiğim kadarıyla
bugüne kadar kullanılmış ve tavsiye edilen bir yöntem değildir.
Yararlı veya zararlı iyon diye bir ayrımı
da doğru bulmuyorum, bitkili akvaryumlarda hatta diğer akvaryumlarda da suda
bulunan hemen her iyon hem yararlıdır hem zararlıdır, zaten bütün mesele
bunları doğru nispetlerde bulundurmak, her bir iyonun yokluğu sorun olduğu
gibi, bitki veya canlının habidatından çok yüksek veya çok az olan her bir
iyonun önemli derecede önemi vardır, tabii bazı iyonlar canlıları etkileme
bakımından diğerlerinden daha etkili olabiliyor. Önemli olan ilgili iyonları doğru nispet ve miktarlarda akvaryum suyunda bulundurabilmek, kısacası sodyum önemsiz diyemeyiz, sadece bu iyon olmasa dünya ve bu günkü canlılık bu şekilde olmazdı diyebilirim, hücre yapısında kullanılmasından tutun da, suda bir iyonik denge sağlamasına kadar, bilmin bu güne kadar söylediği hatta henüz keşfedilmemiş ileride belki önemine değinilecek akıl almaz dengelerin ve etkileşimlerin olduğu süreçler bunlar. Ancak bazı iyonlar suda bulunma miktarları ve canlıların kullanımı ile tükenebilmeleri açısından eksikliği zaman zaman ortaya çıkabilir, bu tür iyonlar daha önemli olduğundan değil de da fazla miktarlarda absorbe edildiğinden, ve bir gösterge niteliğinde kullanılabildiğinden daha önemli gibi addedilebilmektedir. Yani mesela bir suda eğer ca iyon dengesi bozulmuşsa mesela bitki kullanımı veya sair sebeplerle çok çok azalmışsa bu sadece ca iyon dengesinin bozulduğunu göstermekten ziyade aslında sudaki hem her parametrede önemli değişikler olduğunun işareti olur, biz ise su değiştirdiğimizde aslında tüm bu parametreleri düzeltmiş oluruz gibi.
Saygılar.
Üye imzalarını sadece giriş yapan üyelerimiz görebilir
İlk olarak Gh, general hardness, genel sertlik, suda bulunan toplam bileşik miktarını ölçülemede kullanılır. Kalsiyum ve magnezyum artı sudaki tüm iyonlar dolayısıyla oluşur. En basitinden wikipedia veya genel sertlik olarak önce araştırma yapıp sonra tekrar düşününüz. Bir de sertlikten ne anladığımıza bağlı bu iş. Benim kastettiğim şey, saf sudan farklı parçacıkların tümüdür. Ancak bu durum çözünmemiş tüm pparçacıklar olarak da anlaşılabilir. Burada bir karışıklı oluştuysa bu durum için özür dilerim. Dikkatimizi buraya çektiğiniz için de teşekkür ederim.
Kalsiyum ve magnezyum iyonları, karbonat bulunması durumunda, karbonatlı bileşikleri oluşturup KH, carbonate hardness, karbonat sertliğine neden olurlar. Suda karbonat olmazsa kalsiyum da magnezyum da kh artışına neden olmaz.
Benim, alman sertlik sistemi ve ppm arasında belirttiğim ilişki genel bir kuraldır (1gh=17.85ppm). Siz de zaten aynı hesabı kullanmışsınız. Sertlik seviyeleri ile alakalı tablo ise, yabancı forumlarda, hobicilerin yumuşak ve sert saydıkları sınırları belirtmektedir. Yorumunuzda paylaştığınız skala genel olabilir ancal benim tavsiye ettiğim ve belirttiğim skala akvaryum suyu için sertlik ve yumuşaklığı ifade etmek içindir. Sertlik diyerek olaya gizem veya bilimsel hava katmaktansa, suda bulunan iyon miktarı demek daha doğru olur.
CaO ve CaCO3 yorumunuzu barındıran paragraf baştan sona çelişkilerle dolu. Ppm demek, milyon parça çözücüdeki parçacık sayısı demektir. Bu kadar matematiğe girmek bile gereksizken, ısrar edip devam edecek olsak bile CaO ve CaCO3 tuzlarının genel sertliği artıracağı gerçeği var. Hayır karbonat sertliğinden bahsedeceksek, hesaplamak istediğimiz ya da analiz etmek istediğimiz şey nedir? Test kitimiz varsa ve bize Kh 3 diyorsa kh 3tür. Ben daha karbonat sertliği hesabında ne kadar sertliğin hangi iyondan geldiğini hesaplamaya kalkan kişi veya bunu yapmaya yarayan bir enstrüman duymadım görmedim. İyi niyetle derinlere giriyoruz ancak bu gibi garip hesapların kafa karıştırmaktan öteye geçebileceğini düşünmüyorum. Örneklediğiniz gibi 70ppm sertlik olsun diyelim. Oradaki hesabınız da yanlış. O litre başına olan 70mg, 70mg bileşiğe aittir. Uzatıp iddialaşmak istemiyorum ancak araştırırsanız yanlış bildiğinizi anlayacaksınız. Çünkü sunduğunuz iddiaya göre hesaplamaya kalkılacak olunsa, kalsiyumun EDTA kompleksli veya oksitlenmemiş hali de sizce karbonat sertliği yaratıyor.
Kaynatarak kh düşürmeyi lütfen en azından bi wikipedia vb biryerden araştırın. Mesela yüksek sıcaklıkta karbonil merkeze suyun nükleofilik saldırması ve karbondioksit salınımı olarak internette biyerlere aratın. Yorumlarınız tamamen yanlış ve farazi malesef. Su hem asit hem bazdır. Sıcaklığa ve birkaç başka değişkene göre işler düşündüğünüzden farklı yerlere gelebiliyor.
Ph konusu beni en çok üzen kısım oldu. Buna sebep benim yazdıklarıma eleştiri olmasından ziyade en basit kavramları bile yanlış bilip doğru diye yazmanız. Ph sert asit ve bazla ayarlanmaz demişsiniz mesela. Akvaryumda saf su kullansanız dahi ayarlanır. Ki, akvaryum suyu saf su değil. Neyse diyelim ki saf su kullanıyorsunuz akvaryumda. Eğer suyunuza salınım yapan kum vs gibi bir etmen yoksa ph 7den 5e inmez. Ha diyelim ki 2ayda indi, zaten saf su kullanmak zorundaysanız ph'ı sürekli takip etmek durumundasınız.
Hayır, normal bitkili bir akvaryumunuz var TDS metre ile yaptığınız ölçüm 200ppm çıktı. Bu ne demektir? Suda bir takım iyonlar mevcut. Bu iyonlar içinde illa ki tampon yapacak sülfat, fosfat, karbonat, vb kökler bir miktar bulunacaktır. Hadi bulunmasın diyemiyorum çünkü bir tankta canlı var ise bu kökler illa ki oluşacak. Siz de sert bir asit kullanarak ph düşürmek istediniz. Eğer böyle bir deneyiminiz oldu ise, ph, sabit asit eklemesinde once cok yavas degisip, belirli bir degere yaklastikca ( iyon köklerinin kritik noktaları ) cok hızlı değişecektir. Hayatında bir kere titrasyon yapmış birisi, önce suya tahmini değerde tampon kapasitesi bulunan iyon kökü ekleneceğini, ardından hassas ayarlamanın güçlü asit ve bazları seyrelterek yapılacağını bilir. Benim bahsettiğim husus da tam olarak budur. Suyumuzda zaten tampon kapasitesi bulunduran bir miktar iyon kökü mevcut. Hassas ayarlama ile ph sabit bir değerde, bu iyonlarca tutulur. Bu mekanizma, bir denge mekanizmasıdır.
Suya karbonat katarak ph sabitlemek tek çözümdür demek daha da vahim. Kristal karides bulunan bir akvaryumun ph ını sabitlerken ne yapılacak o zaman? Kaldı ki sülfat, vb gibi başka tampon kapasiteli iyon kökleri de mevcut. Neden karbonat kullanmak zorunda olunsun ki? Tamam, karbonat yeraltı sularınca beslenen göllerde yoğun bulunuyor diye yüksek ph oluşturuyor ama, aradaki denge mekanizmasını ( le chatelier prensibi ) sola çekecek seyreltilmiş bir baz kullanımı neden mümkün olamıyor?
Gerekli gereksiz iyon konusu da bir başka sorun. Bunu da kısaca şu şekilde açıklayayım. Zararlı demekten kastım, yosun oluşturma potansiyeli, enzim inhibitör etkisi, vb hususlar oluşmasıdır. Gereksizden kastım ise, bitkilerce çok ihtiyaç duyulmamasıdır. Sodyum periyodik cetvelde potasyumla aynı gruptadır (1A) ve bu iki iyon çok yakın ancak ince farklılıklar barındıran özelliktedirler. Bitkiler potasyumu seçmişler. Dünyamızın akılalmaz keşif ve dengeleri böyle buyurduğu için, suda yüksek miktarda sodyum bulunması bir anlam ifade etmeyecektir çünkü bitkiler katyon gereksinimlerini çoklukla potasyum ile karşılayacak şekilde evrilmişler.
Saygılar, selamlar
Üye imzalarını sadece giriş yapan üyelerimiz görebilir
Üye imzalarını sadece giriş yapan üyelerimiz görebilir
Üye imzalarını sadece giriş yapan üyelerimiz görebilir
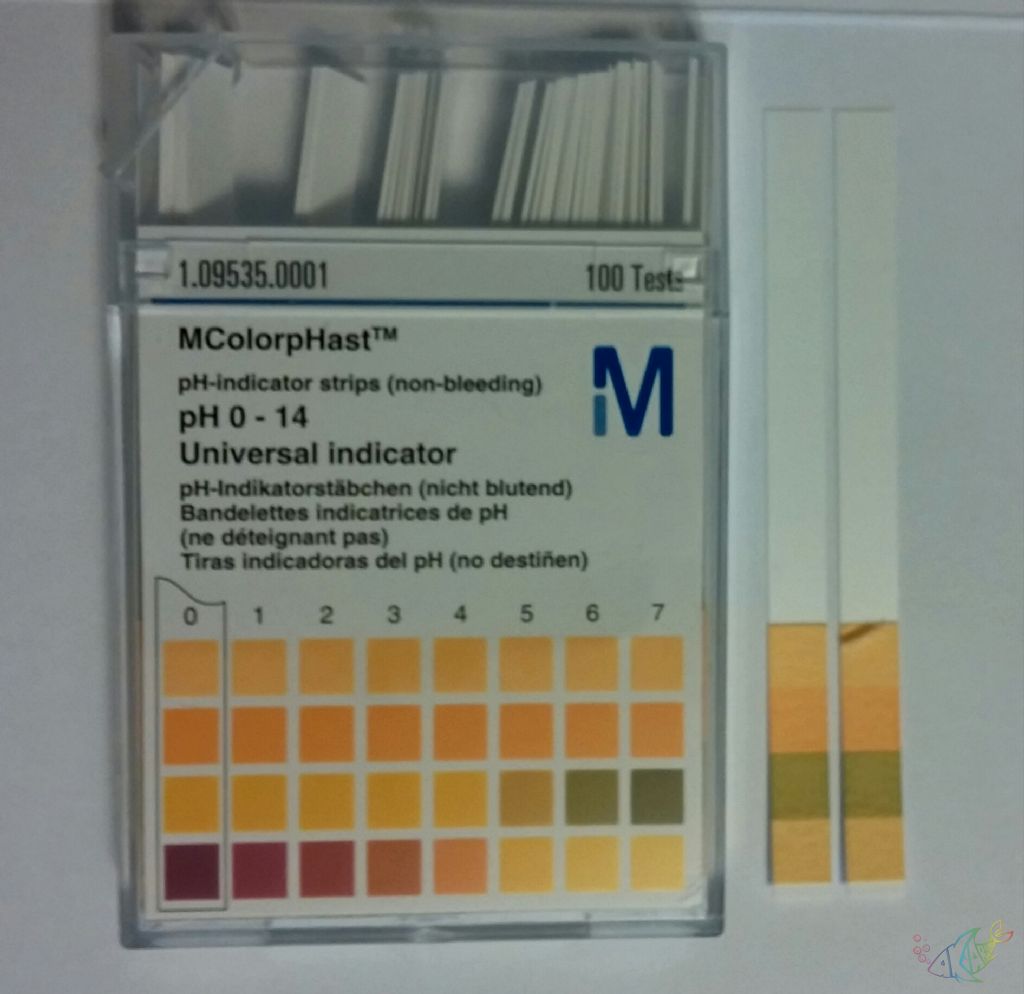
Istanbul Maltepe ilcesinde şehir şebeke suyu kullaniyorum. Tanka eklemeden once 2 gun dinlendiriyorum. Kullanim sekline gore su duzenleyisi Ilave. Merck Mcolorphast aldim. Kutuda 100 adet var. Istocta 15/20 tl arasinda. Net sonuc vermesede skaladan tahmin edebilirsiniz. Ani değişimler gozlemlenebilir, Yada kök kaya ve bitkilerin etkileri test edilebilir.
55 lt de 2 ortaboy ve 4 kucukboy japon türü bakiyorum. 1er Salyangoz ve midye. Anubiaslar öldü. Haftada 1 su degisimi. Ilk olcum degeri 6.5. %30 Su degisimi ile ikinci olcum 7.5. Sonuc dogru ise kirlenmenin ph yı düşürdüğü göruluyor. Fotograf bu basit kite ait. Faydali bir alet 😄
Üye imzalarını sadece giriş yapan üyelerimiz görebilir
Beğenenler: [T]124083,Serkan Odabaşı[/T]
Üye imzalarını sadece giriş yapan üyelerimiz görebilir
Deneyierimi bilginizle harmanlamak harika olacak. ilk defa ph ölçümü yapmis birine oturup vakit ayirdiginiz icin de ayrica teşekkür ediyorum.
Sistemim ile bir takım sıkıntılar yaşadığım için bu olcum metodunu test etmeye başladım. Verdiginiz bilgiler isiginda degerlendirmerimi gozden gecirecegim.
Saygılar.
Üye imzalarını sadece giriş yapan üyelerimiz görebilir
Üye imzalarını sadece giriş yapan üyelerimiz görebilir
Bunun dışında hobi, işin içine malesef çok fazla bilimsel terim sokma gayretiyle sulandırılıyor. Elbette su değerlerini takip edip, optimum değer yakalama gayreti göstermek, hem bitkilerin hem de canlıların sağlıklı gelişimi için büyük bir gereklilik. Ancak sizin de tecrübe ettiğiniz gibi işler bu kadar karışık değil. Kh nedir bilmeden de elbette çok gùzel bir bitkili akvaryum kurulabilir. Veya Gh 2.5 ne demektir bilmeyen bir hobici, akvaryumun Gh'ından bihaber birisi bir bitkili akvaryum kuramaz mı? Kurar, ve gözlemleri doğrultusunda en güzelini de yapar. Benim bu başlığı açmamın nedeni, çok terim kullanıp, yaptığı işi kaliteli diye satan cahil kişilerin hobiye zarar vermesini engellemeye çalışmaktır. Naçizane mesleğim icabı aşina olduğum terimlerin anlamını bana öğretildiği şekliyle paylaştım. Bunlar hangi kimya kitabının kapağını açsanız kolaylıkla bulabileceğiniz bilgiler. Sorun şu ki, bilim bizim toplumumuzda bir yere kadar bilim. Bir yerden sonra insanlar, garip terim ve jargonlarla bilimden uzaklaştırılıyor. Hobi de aynı şekilde. İnsanlar bitki bakmaya teşvik edileceklerine, önlerine afilli malzemeler, janjanlı metod ve yöntemler çıkarılıp tek doğru budur diye dikte ettiriliyor. Daha da fazlası, siz bir işin ne kadar ihtisasını da yapsanız, tecrübeli de olsanız cahil insanların sesi hep daha yüksek çıkıyor malesef. Temennim, hobiye gönül vermiş kişilerin bu kompleks işlere kulak asmadan ancak doğru bilgi ve metodlar ışığında gönüllerince hobiyi yaşamalarıdır. Çünkü yabancı forumlarda başarılı olan akvaryum dizaynlarını kopyalayıp tank kurarak veya en pahalı malzemeleri kullanarak hobici olunmuyor. Saygılar, selamlar.
Üye imzalarını sadece giriş yapan üyelerimiz görebilir
Bir de, hobiciler
çok zekidir, çoğu diyorlar ki, biz bu hükümetin eğitim politikasını pek
beğenmiyoruz, iki oda bir salon yerleri üniversite yapıyorlar, eğitim kalitesi
çok düşüyor diyorlar. Bilmiyorum bu yaklaşım da doğru olabilir. Diğer taraftan
bir şey daha ekleyeyim, üniversitede adama birşey öğretmezler, kendiniz
isterseniz birşeyler öğrenirsiniz.
Asıl gerçek şu ki,
Öğrenmenin sonu
yok, öğrendikçe hiçbirşey bilmediğinizi öğreniyorsunuz ve aynı zamanda
gerçekten hiçbirşey bilmeyenlerin birşey biliyormuşcasına konuşmalarını
hayretle izliyorsunuz.
Okuyanlar yararlansın diye son mesajınız da da bazı düzeltmeler yapmayı uygun görüyorum.
Öncelikle, nitrat döngüsü, biyolojik döngü, azot döngüsü kavaramları birbirlerinden biraz farklıdır.
Nitrat döngüsü
derseniz, mesela yem gibi organik bir maddedeki, organik azotun önce amonyak
azotuna sonra nitrit ve nitrat azotlarına geçiş sürecini ifade etmiş olursunuz.
Yani nitrat döngüsü, organik azot, nh3 no2 no3 süreçleri olup orada kalır. Azot
döngüsü derseniz, azotun tekrar mineralizasyonuna kadar oluşan süreci de
eklemiş olursunuz, yani nitrat sürecinden sonra denitrifikasyon süreci de işin
içine girer. Ancak biyolojik döngü derseniz, tüm bu azot döngüsü yanında,
karbon, kükürt (sülfür) vesair döngüleri de kapsayacak birşey söylemiş
olursunuz. Bu döngülerin çoğu oksijensiz ortamda ve çoğunlukla kumun altında
oluştuğundan, burada üreyen ürünler mesela co2 ch4 h2s, oksitlendiğinde h2so4,
yine bunun gibi tannik hümik asit gibi asıl asitleyici (ph düşürücü
anlamında) ürünler bu safhada oluşur. Yani nitrat döngüsü değilde akvaryuma yem
attığınızda, oturmuş akvaryumdaki biyolojik hatta biyokimyasal döngünüz asıl
sonuçları yaratır. Yani akvaryuma ha yem atmışsınız ha asit dökmüşsünüz gibi
düşünün. Tabii oturmuş akvaryum, oturmuş filtreli bir ortam olacak.
Diğer taraftan bu
süreçler hep iyi işleyen biyolojik filtrasyonla ilişkili olup, ne fazlaca
filtrenin gücü veya su sürkilasyonu ile ilişkilidir. Hiç filtresi olmayan bir
akvaryumda bile iyi işleyen bir biyolojik döngü olabilir, bu daha çok bakteri
faaliyetleri ile ilişkilidir. Yani filtrelemenin zayıf kalması, ph ı düşürür
demek yerine, iyi filtrasyon ph ı daha iyi düşürür demek gerekir. İyi
filtrasyonunuz olmazsa yukarıda süreçler oluşmaz, ne sülfür bakterisi iş yapar,
ne karbondioksit oluşur ne de kimi organik asitler oluşamaz. Yani kötü veya
zayıf dediğiniz filtrasyon ph ı daha az düşürür. Bu açılardan filtrenin zayıf
kalması veya nitrat döngüsünden ötürü düşüş olabilmekte cümleleri tamamen
hatalıdır. İyi filtrasyon olmazsa organik azot, amonyak azotu formunda kalır,
döngünün durumuna göre nitrit veya biraz nitrat da üretebilir. Amonyak
baziktir, ancak suda ph durumuna göre de amonyağın çoğu amonyum iyonuna dönüşür.
NH3 + H2O => NH4 + + OH . Yani amonyak nh4 e dönüşürken oh iyonu
açığa çıkarır. Bunun anlamı da şu, iyi filtrasyon olmazsa amonyak olur, o da
ilk hamlede ph yükseltici etki gösterir. Biyolojik filtrasyon iyi çalışıyorsa
da amonyak birimimi olmaz, nh4 e dönen azot, nh3 nitrite dönüştürüldükçe nh4
den tekrar nh3 doğru dönüşür, (bunun bir
ph bağımlı oran ve dönüşüm tablosu vardır isteyenler arayıp bulabilir) amonyak
bakteriler tarafından kullanıldıkça artı
ph lehine oluşan durum tersine dönmüş
olur ve diğer biyolojik ve biokimyasal asitleyici süreçler ph düşürür.
Sonuç, hiçbir hobici için sizin ne, ne okuduğunuz ne de ne okumadığınızın hiçbir önemi yok. Diğer bir konudan gördüğüm kadarıyla ticarete yatkın olduğunuz anlaşılıyor, zaten bir ürün üretip pazarlamaya çalışıyorsunuz, bu gayet normal ve olağan bir durum ancak, aynı ticaret mantığı ile hatalı bilgi pazarlamaya kalkışmanın mantığı nedir, kime ne faydası olacak. Bana öyle öğretildi, kimya kitabı öyle yazmıştı, yok benim mesleğim diyerek hobiciler değerlendirsin demenin anlamı nedir. İki çarpı iki dört ediyorsa 4 ediyordur, şimdi 5 oluğuna mı karar verilecek. Siyasetçilerin vatandaşı kandırdığı mantıkla, hobiciyi seçmen kitlesi gibi ele alıp %51 Harun bey size bravo çok iyi yazmışsınız denilince mutlu mu olacaksınız. Neden acaba karşı birşeyler yazılmış, bilgilerimde bir yanlışlık olabilir biraz araştırıp gerekirse düzelteyim diyemiyorsunuz. Belki tekrar bir araştırsaydınız, belki ya çinko demir gibi birkaç daha metal gh a etki edebiliyormuş diyebilir, ben de size bunun neden bir önemi olmadığını yazabilir ve hobicilerde yeni birşeyler daha öğrenmiş olurlardı. Yani siz elinizdeki kimya kitabını atarsanız iyi olacak. Son olarak, kişinin kendi gayret göstermelidir ve cahil insanların sesi çok çıkıyor şeklindeki fikirlerinize de katılıyorum.
Saygılar.
Üye imzalarını sadece giriş yapan üyelerimiz görebilir
Üye imzalarını sadece giriş yapan üyelerimiz görebilir